본 post는 질병관리청 유전자검사기관 종사자 교육(2023)의 ‘1차시 - 유전자검사의 이해’를 정리한 내용입니다.
유전자검사의 발전과 성장
검사 기술 개발 및 비용 감소가 이루어 졌습니다. 차세대 염기서열 분석법(NGS)의 개발로 대용량의 염기서열을 동시에 분석할 수 있게 되었습니다. 이는 1세대 염기서열 분석법인 Sanger sequencing에 비해 분석시 소요 비용이 감소함에 따라 임상적 활용이 크게 증가하게 되었습니다.
HGP(Human Genome Project)가 진행된 2003년 당시 인간 유전체 분석에 소요되는 비용이 대략 1억 달러였던 것에 반해 현재는 1,000 달러 가량으로 약 10만배 감소 되었습니다.
유전자검사에 있어서 검사 기술과 함께 중요한 또 다른 요소는 검사 결과가 의미하는 바입니다. 유전자검사로 확인된 유전변이들을 어떻게 해석할 수 있는지가 중요합니다. 이것은 유전자검사로 확인할 수 있는 ‘유전정보’와, 이전에 동일한 유전정보를 가진 사람들에게 나타났었던 ‘임상적인 특징’을 데이터베이스화 해야합니다. 따라서 유전체 관련 공공 데이터베이스의 구축이 필요합니다. 이러한 데이터베이스는 유전자검사를 임상적으로 활용하는 데 많은 도움을 주고, 유전자검사를 적극적으로 활용할 수 있게 합니다. 현재 공개된 공공 데이터베이스로는 OMIM, ClinVar, gnomAD, GWAS Catalog 등이 있습니다.
 유전체 관련 공공 데이터베이스
유전체 관련 공공 데이터베이스
https://nih.kohi.or.kr/
국가 주도의 대규모 유전체 프로젝트가 진행 중이며, NGS 검사법 개발과 더불어 미래 의료를 선도하고자 하는 각국의 국가적인 투자가 진행되고 있습니다.
영국은 100,000 Genome Project와 UK BioBank, 미국은 All of Us, 한국은 국가 통합 바이오 빅데이터 구축사업이 대표적인 사례입니다.
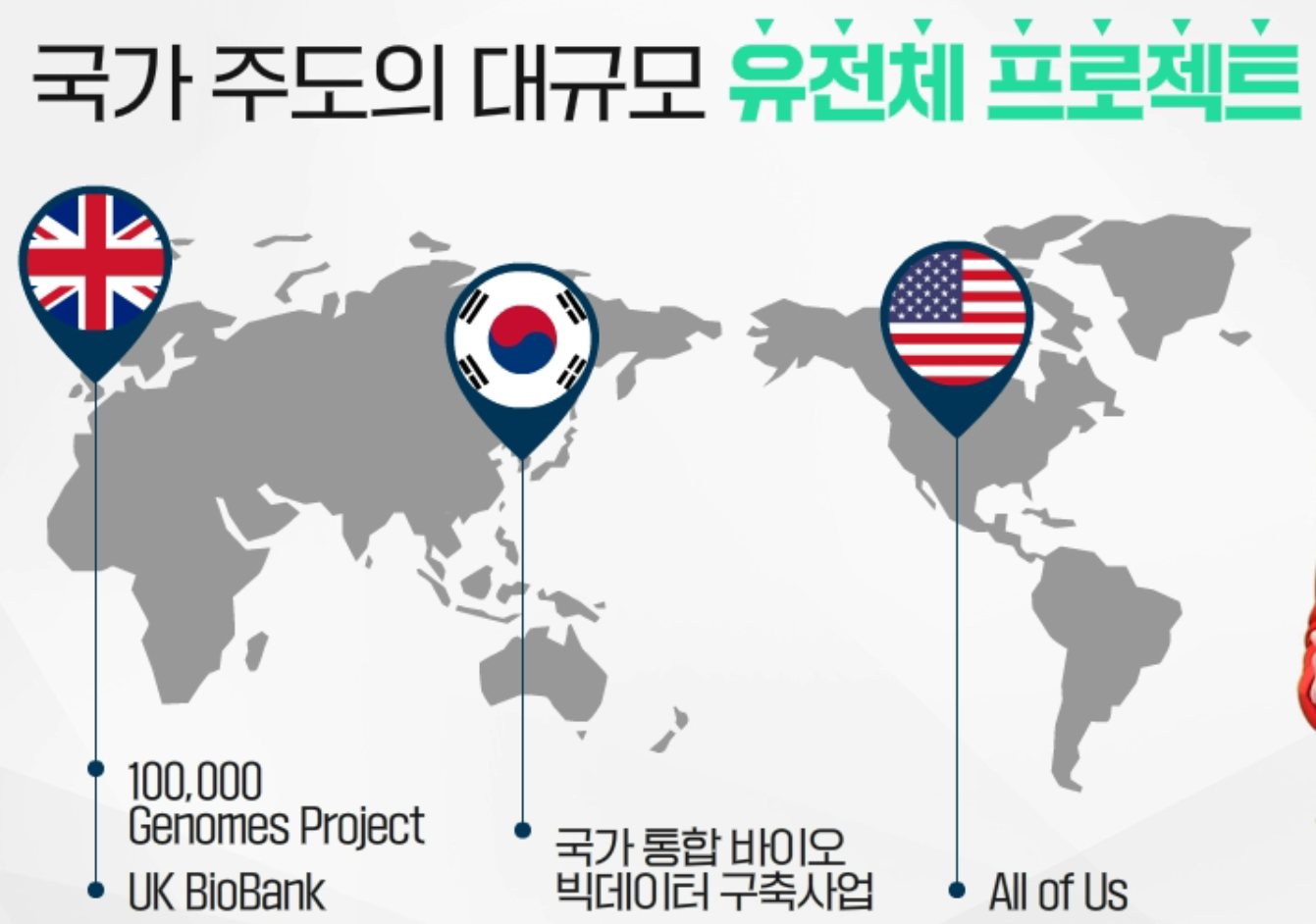 국가 주도의 대규모 유전체 프로젝트
국가 주도의 대규모 유전체 프로젝트
https://nih.kohi.or.kr/
유전자검사의 활용
유전자검사는 질병의 진단 및 치료에 활용하고 있습니다. 증상 전 진단(presymptomatic diagnosis), 산전진단 및 착상 전 진단(prenatal diagnosis and preimplantation diagnosis), 약물유전검사(pharmacogenetic testing)에 활용하면서 유전자검사 기술 및 치료제 개발의 비약적인 발전이 이루어지고 있습니다.
 질병의 진단 및 치료 활용
질병의 진단 및 치료 활용
https://nih.kohi.or.kr/
또한 질병의 진단 및 치료 외에도 다양한 목적으로 활용되고 있습니다. 질병 에측, Wellness, 유전적 혈통 찾기, 친자확인 등에 활용되고 있습니다.
국내 유전자검사 현황
2023년 3월 31일 기준 국내 유전자검사기관은 265개소 신고되어 있습니다.
 국내 유전가검사기관 신고 현황
국내 유전가검사기관 신고 현황
https://nih.kohi.or.kr/
국내 유전자검사 관련 정책은 우리나라 국민이라면 누구나 국민건강보험의 혜택을 받을 수 있습니다. 의료기관에서 질병의 진단 및 치료에 활용되는 유전자검사는 국민건강보험 급여의 대상이 됩니다. 관계부처별 관리 내역을 살펴보면 보건복지부는 의료법, 국민건강보험법 및 생명윤리법에 따라 유전자검사 전반 관리, 질병관리청은 생명윤리법에 따라 유전자검사기관의 신고 수리 및 관리, 식품믜약품안전처는 체외진단의료기기법에 따라 통과된 검사 장비로 시행되는 유전자검사 관리를 담당하고 있습니다.
 국내 유전자검사 관련 정책 담당기관1
국내 유전자검사 관련 정책 담당기관1
https://nih.kohi.or.kr/
건강보험심사평가원은 유전자검사 관련 요양급여의 적정성과 타당성 평가, 한국보건의료연구원은 새로운 유전자검사에 대한 신의료기술 적용 여부 평가, 한국유전자검사평가원은 유전자검사에 대한 숙련도 평가, 국가생명윤리정책원은 DTC 유전자검사 서비스에 대한 검사역량 인증처리를 담당하고 있습니다.
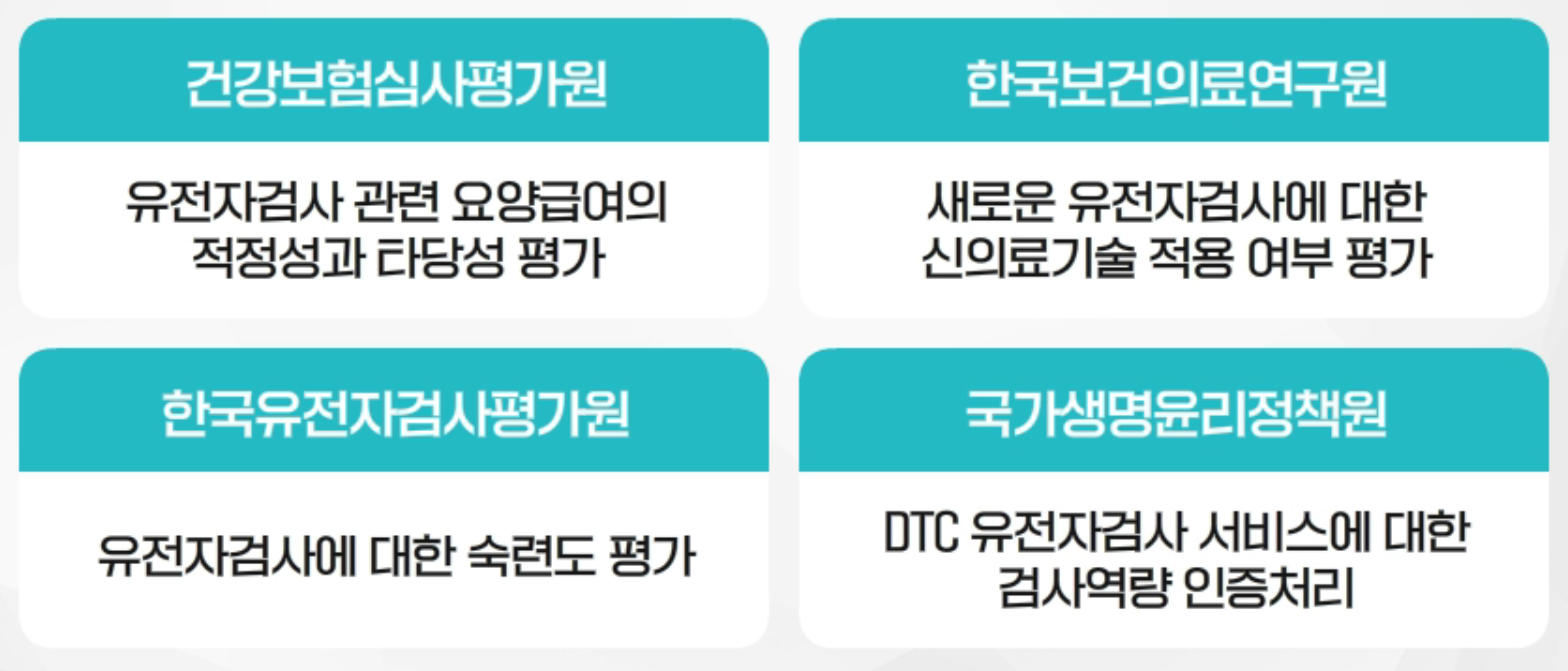 국내 유전자검사 관련 정책 담당기관2
국내 유전자검사 관련 정책 담당기관2
https://nih.kohi.or.kr/
의료기관은 기관 특성상 유전자검사의 질관리를 실시하고 있습니다. 만약 우수한 질관리가 유지되지 않는다면 검체검사에 대한 질 가산율 등에 제한을 받을 수 있습니다. 진단검사분야는 진단검사의학재단의 우수검사실 신임인증평가에서 우수한 점수를 받아야 합니다. 대한임상검사정도관리협회의 신빙도 조사사업에서 품질인증을 획득해야 합니다. 병리학분야는 대한병리학회의 정도관리/인증평가에서 적합 판정 및 우수한 등급을 획득해야 합니다.
이처럼 유전자검사기관은 관련 법에 따른 책임과 의무를 준수해야 합니다. 또한 검사실의 질 수준 향상 및 유지하는 것이 중요합니다.
국외(미국) 유전자검사 정책
CLIA(Clinical Laboratory Improvement Amendments): 사람의 검체를 대상으로 ‘체외진단검사를 수행하는 검사실’은 인력, 외부정도관리평가, 질관리, 검사관리의 시스템, 시설 운영 등의 부분에 대해 ‘CLIA에서 규정하는 주요한 요건’ 등을 반드시 충족해야만 합니다.
미국병리협회(CAP)의 검사실 인증 프로그램: 검사결과의 정확성과 환자 진단의 정확성을 유지하기 위해 외부정도관리 평가 및 검사실 현장평가 등을 받습니다. 미국의 CMS(Centers for Medicare & Medicaiid Services)에서는 미국병리협회에 검사실의 질평가를 할 수 있는 권한을 위임합니다.
미국에서도 DTC(Direct to Consumer) 유전자검사 서비스가 시행되고 있는데, 정책적인 변화를 가져온 계기가 있습니다. 2003년 HGP가 완성된 이후 2005년부터 DTC 유전자검사 회사들이 설립되었습니다. 2010년 미국회계감사원이 DTC 유전자검사 회사들의 검사결과를 검토하여 보고서를 발표했는데, 주요 이슈사항은 유전자검사 회사마다 분석결과가 상이하다는 점이었습니다. 2013년 FDA는 건강 관련 DTC 유전자검사 서비스의 영업 중단을 권고했습니다. 2015년부터 저위험도 유전자검사를 제외한 DTC 서비스들에 대해 FDA 검토 및 허가가 필요하도록 정책이 변경되었습니다.
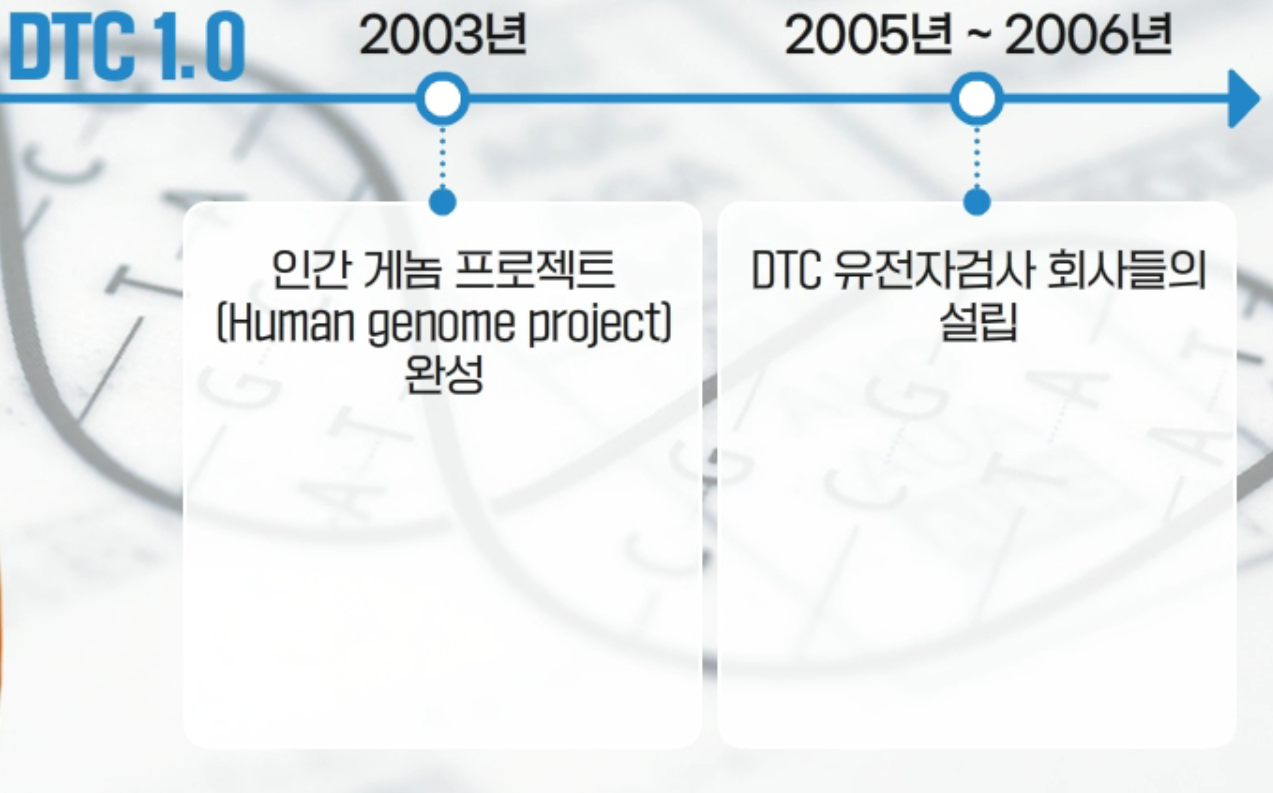 미국의 DTC 정책 변화1
미국의 DTC 정책 변화1
https://nih.kohi.or.kr/
 미국의 DTC 정책 변화2
미국의 DTC 정책 변화2
https://nih.kohi.or.kr/
Take Home Message
NGS 개발로 인하여 유전자검사 비용이 감소했습니다. 유전체 관련 공공 데이터베이스 구축의 중요성이 대두되면서 국가 주도 대규모 유전체 프로젝트가 진행되고 있습니다. 이러한 유전자검사는 질병의 진단, 치료를 위한 활용 뿐만 아니라 질병 예측, 예방, 유전적 혈통 찾기, 개인식별, 친자확인 등 다양한 목적으로 활용되고 있습니다. 국내/외 유전자검사기관 현황과 정책변화 등을 확인했습니다.